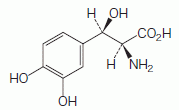
1
広橋敦子ほか: 薬理と治療. 1987; 15(Suppl.2): 283-299
2
水野佳子ほか: 薬物動態. 1987; 2: 509-518
3
鈴木友和ほか: 薬理と治療. 1987; 15(Suppl.2): 381-400
4
鈴木友和ほか: Eur. J. Clin. Pharmacol. 1982; 23: 463-468
5
鈴木友和ほか: Neurology. 1984; 34: 1446-1450
6
椿原美治ほか: 医学と薬学. 1997; 37: 401-410
7
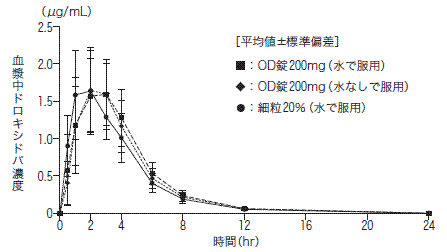
社内資料: OD錠と細粒の生物学的同等性試験
8
庄野文章ほか: 薬物動態. 1987; 2: 53-70
9
楢林博太郎ほか: 臨床評価. 1987; 15: 423-457
10
楢林博太郎ほか: 薬理と治療. 1987; 15(Suppl.2): 411-443
11
祖父江逸郎ほか: 医学のあゆみ. 1987; 141: 353-378
12
鈴木友和ほか: 厚生省特定疾患「原発性アミロイドーシス調査研究班」61年度報告書. 1987; 223-226
13
秋澤忠男ほか: 腎と透析. 1997; 42: 527-550
14
越川昭三ほか: 透析会誌. 1997; 30: 941-959
15
椿原美治ほか: 腎と透析. 1997; 43: 571-583
16
加藤照文ほか: Biochem. Pharmacol. 1987; 36: 3051-3057
17
中村三孝ほか: 薬理と治療. 1987; 15(Suppl.2): 367-373
18
仙波純一ほか: Psychiatry Research. 1985; 15: 319-326
19
加藤照文ほか: Pharmacol. Biochem. Behav. 1987; 26: 407-411
20
笹 征史ほか: Brain Research. 1987; 420: 157-161
21
加藤照文ほか: Naunyn-Schmiedeberg's Arch. Pharmacol. 1986; 332: 243-246
22
勝山美智子ほか: Arch. Int. Pharmacodyn. Ther. 1986; 283: 61-70
23
直井 信ほか: J. Neural Transmission. 1987; 70: 51-61
24
西野直樹ほか: J. Pharmacol. Exp. Therap. 1987; 242: 621-628
25
荒木宏昌ほか: J. Pharm. Pharmacol. 1981; 33: 772-777
26
佐藤 進ほか: Arzneim.-Forsch./Drug Res. 1989; 39: 1123-1129
27
加知輝彦ほか: Neurology. 1988; 38: 1091-1094
28
相野博司ほか: 基礎と臨床. 1996; 30: 3141-3150
29
相野博司ほか: 基礎と臨床. 1996; 30: 3131-3139