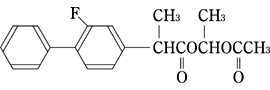
1
今井正彦 他:医薬品研究.1989;20:42-47
2
今井正彦 他:薬理と治療.1988;16:3671-3687
3
今井正彦 他:薬理と治療.1988;16:3689-3712
4
今井正彦 他:薬理と治療.1988;16:3731-3741
5
今井正彦 他:薬理と治療.1988;16:3713-3730
6
東野正男 他:基礎と臨床.1992;26:3907-3921
7
東野正男 他:基礎と臨床.1988;22:4031-4045
8
古江尚 他:臨牀と研究.1989;66:1622-1630
9
古江尚 他:臨牀と研究.1989;66:2303-2311
10
百瀬隆:基礎と臨床.1989;23:2141-2146
11
古江尚 他:臨牀と研究.1989;66:2014-2024
12
百瀬隆:基礎と臨床.1989;23:2921-2926
13
平賀一陽 他:基礎と臨床.1988;22:6523-6534
14
松村公人:基礎と臨床.1989;23:917-922
15
小川郁 他:基礎と臨床.1989;23:699-704
16
吉野肇一:新薬と臨床.1989;38:166-174
17
富岡峰敏 他:診療と新薬.1989;26:290-299
18
古江尚 他:医学と薬学.1989;21:370-377
19
栗山澄 他:日本薬理学雑誌.1989;93:61-73
20
社内資料:ラット胃障害誘起作用-同種同効注射薬との比較試験-