1
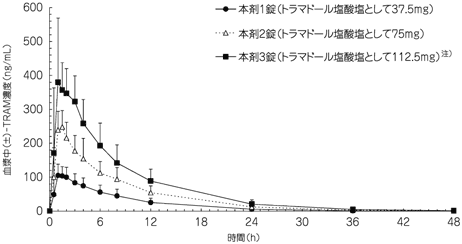
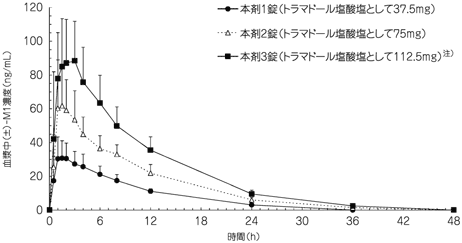
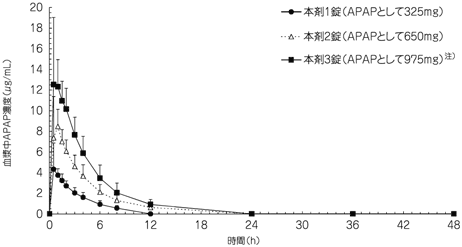
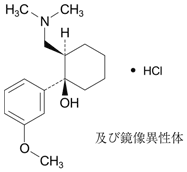
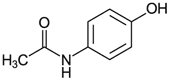
社内資料:トラムセット配合錠の国内第Ⅰ臨床試験(2011年4月22日承認、CTD2.7.6.3)
2
社内資料:トラムセット配合錠の海外第Ⅰ相臨床試験(2011年4月22日承認、CTD2.7.6.2)
3
社内資料:トラマドールの蛋白結合率の検討(2011年4月22日承認、CTD2.7.2.2.1)
4
Gazzard BG, et al.:J Pharm Pharmacol. 1973;25:964-967
5
社内資料:トラマドールの代謝の検討(2011年4月22日承認、CTD2.7.2.2.1)
6
社内資料:トラマドールの代謝酵素の検討(2011年4月22日承認、CTD2.7.2.2.1)
7
Thummel KE, et al.:Biochem Pharmacol. 1993;45:1563-1569
8
Raucy JL, et al.:Arch Biochem Biophys. 1989;271:270-283
9
Goodman & Gilman's the pharmacological basis of therapeutics. 11th ed., The McGraw-Hill Companies, 2006;693-695
10
Zapater P, et al.:Ailment Pharmacol Ther. 2004;20:29-36
11
Prescott LF, et al.:Eur J Clin Pharmacol. 1989;36:291-297
12
社内資料:トラムセット配合錠の国内第Ⅲ相試験(2011年4月22日承認、CTD2.7.6.6)
13
社内資料:トラムセット配合錠の国内第Ⅲ相試験(2011年4月22日承認、CTD2.7.6.17)
14
社内資料:トラムセット配合錠の国内第Ⅱ/Ⅲ相試験(2011年4月22日承認、CTD2.7.6.19)
15
Raffa RB, et al.:J Pharmacol Exp Ther. 1992;260:275-285
16
Raffa RB:Am J Med. 1996;101(suppl 1A):40S-46S
17
Björkman R, et al.:Pain. 1994;57:259-264
18
Pelissier T, et al.:J Pharmacol Exp Ther. 1996;278:8-14
19
Tallarida RJ, et al.:Life Sciences. 1996;58:PL-23-PL-28
20
社内資料:アジュバント関節炎ラットにおけるトラマドール塩酸塩及びアセトアミノフェン併用投与による鎮痛作用(2011年4月22日承認、CTD2.6.2.2.3.2)