1
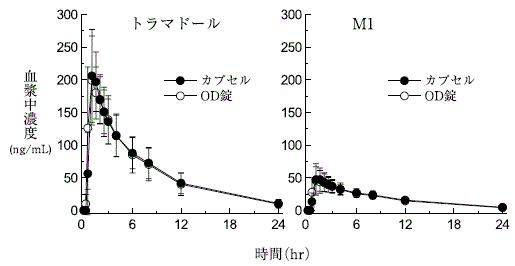
トラマドール塩酸塩OD錠とカプセルの生物学的同等性試験(承認年月日:2014年9月16日、CTD 2.7.6.1)
2
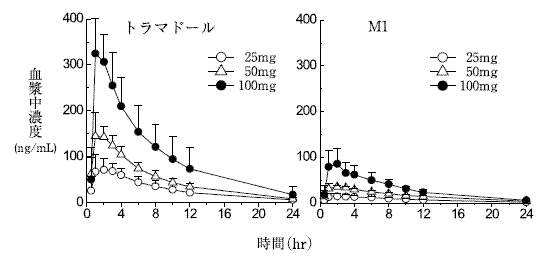
大熊誠太郎ほか:臨床医薬, 2010;26(8):497-512
3
ラットを用いた組織分布試験(承認年月日:2010年7月23日、CTD2.6.4.4)
4
血漿タンパク結合試験(承認年月日:2010年7月23日、CTD2.7.2.2.1.1)
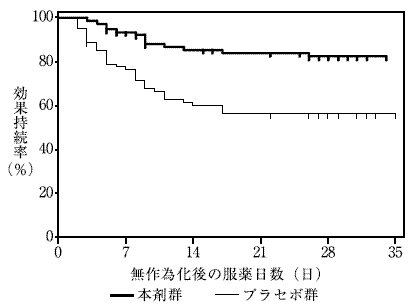
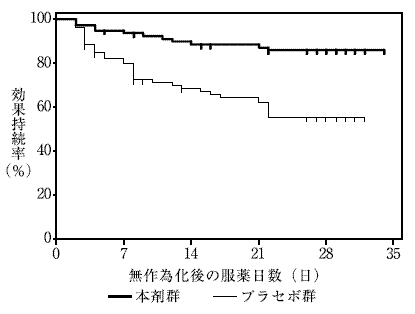
5
代謝に対する評価(承認年月日:2010年7月23日、CTD2.7.2.3.1.4)
6
in vitro代謝試験(承認年月日:2010年7月23日、CTD2.7.2.2.1.2)
7
平賀一陽ほか:臨床医薬. 2010;26(8):569-84
8
小川節郎ほか:臨床医薬. 2013;29(6):497-512
9
小川節郎ほか:臨床医薬. 2013;29(6):513-30
10
小川節郎ほか:臨床医薬. 2013;29(6):531-46
11
Frink MC, et al. : Arzneimittelforschung. 1996;46(Ⅱ):1029-36
12
Raffa RB, et al. : J Pharmacol Exp Ther. 1992;260(1):275-85
13
Hennies HH, et al. : Arzneimittelforschung. 1988;38(Ⅱ):877-80
14
Kaneko K, et al.:Neurosci Lett. 2014;562(Mar 6):28-33



 132
132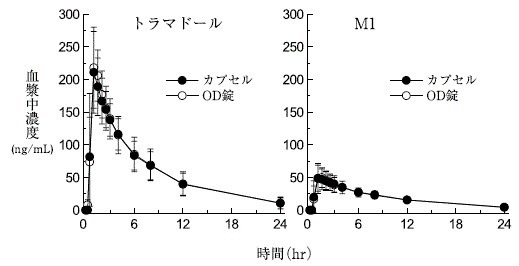
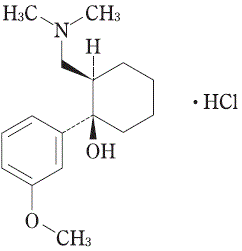 及び鏡像異性体
及び鏡像異性体

