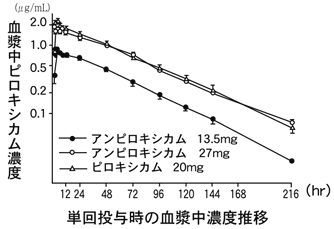
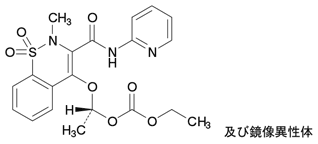
1
堀本 政夫ほか:応用薬理.1991;42(6):559-569
2
社内資料:アンピロキシカムのラット胎児動脈管に及ぼす影響[L20070418010]
3
Ostensen, M.:Eur J Clin Pharmacol.1983;25(6):829-830
4
Ostensen, M. et al.:Eur J Clin Pharmacol.1988;35(5):567-569
5
Jacotot, B.:Proceedings of 9th European Congress of Rheumatology.1979:46-47
6
宮川 朋大ほか:精神医学.1996;38(2):205-207
7
厚生省薬務局企画課監修:医薬品相互作用ハンドブック薬業時報社.1992:195
8
Baker, D. E.:Drug Intell Clin Pharm.1988;22(6):505-506
9
Ferry, D. G. et al.:Eur J Clin Pharmacol.1990;39(6):599-601
10
Mendonça, L. L. F. et al.:Rheumatology.2000;39(8):880-882
11
Akil, M. et al.:Br J Rheumatol.1996;35(1):76-78
12
Smith, G. et al.:Br J Rheumatol.1996;35(5):458-462
13
Calmels, C. et al.:Rev Rhum Engl Ed.1999;66(3):167-168
14
金沢 真雄ほか:炎症.1991;11(1):81-90
15
岩田 久ほか:医学と薬学.1991;25(6):1645-1654
16
菅原 幸子ほか:炎症.1991;11(6):597-605
17
藤巻 悦夫ほか:臨床医薬.1990;6(9):1829-1857
18
菅原 幸子ほか:臨牀と研究.1991;68(11):3569-3580
19
青木 虎吉ほか:薬理と治療.1991;19(6):2267-2292
20
井田 英雄ほか:医学と薬学.1991;25(6):1669-1684
21
岩佐 悟ほか:医学と薬学.1991;25(6):1685-1696
22
増田 明敏ほか:医学と薬学.1991;25(6):1697-1712
23
入交 昭一郎ほか:炎症.1992;12(1):81-92
24
佐々木 孝ほか:医学と薬学.1991;25(6):1616-1643
25
鈴木 明夫ほか:Progress in Medicine.1991;11(6):1544-1554
26
菅原 幸子ほか:医学と薬学.1991;25(6):1655-1668
27
山中 教造ほか:応用薬理.1991;41(6):597-612