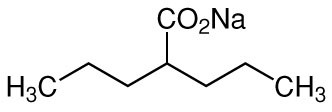
1
Bowden CL, et al. : JAMA. 1994; 271: 918-924
2
Pope HG Jr, et al. : Arch Gen Psychiatry. 1991; 48: 62-68
3
Meador KJ, et al. : Lancet Neurol. 2013; 12: 244-252
4
Christensen J, et al. : JAMA. 2013; 309: 1696-1703
5
Delgado-Escueta AV, et al. : Neurology. 1992; 42: 149-160
6
Riva R, et al. : Clin Pharmacokinet. 1996; 31: 470-493
7
武田明夫ほか : てんかん研究. 1988; 6: 196-203
8
小林智ほか : 臨床薬理. 1994; 25: 419-428
9
Levy RH, et al. : Antiepileptic Drugs. 4th ed. New York: Raven Press; 1995. p605-619
10
Perucca E, et al. : Br J Clin Pharmacol. 1984; 17: 665-669
11
緒方宏泰ほか : 臨床薬物動態学-薬物治療の適正化のために-. 東京: 丸善; 2000. p125-128
12
Zaccara G, et al. : Clin Pharmacokinet. 1988; 15: 367-389
13
久木野和暁ほか : 久留米医学会雑誌. 1971; 34: 369-379
14
Vajda FJE, et al. : Neurology. 1981; 31: 486-487
15
Ishizaki T, et al. : Pediatr Pharmacol. 1981; 1: 291-303
16
前田共秀ほか : 九州薬学会会報. 1986; 40: 27-30
17
武田明夫ほか : 脳と発達. 1976; 8: 401-408
18
Gómez BMJ, et al. : J Clin Pharm Ther. 1993; 18: 191-197
19
Scheyer RD, et al. : Antiepileptic Drugs. 4th ed. New York: Raven Press; 1995. p621-631
20
Anari MR, et al. : J Chromatogr B. 2000; 742: 217-227
21
Jin C, et al. : J Pharmacol Exp Ther. 1993; 264: 475-479
22
龍原徹ほか : 臨床薬理. 1988; 19: 749-757
23
Gugler R, et al. : Eur J Clin Pharmacol. 1977; 12: 125-132
24
河合逸雄ほか : 診療と新薬. 1988; 25: 2037-2045
25
村田忠良ほか : 診療と新薬. 1988; 25: 2073-2082
26
太田秀臣ほか : 診療と新薬. 1988; 25: 2111-2116
27
大田原俊輔ほか : 診療と新薬. 1988; 25: 2013-2021
28
Kukino K, et al. : Chem Pharm Bull. 1977; 25: 2257-2262
29
Emrich HM, et al. : Arch Psychiat Nervenkr. 1980; 229: 1-16
30
Cutrer FM, et al. : Br J Pharmacol, 1995; 116: 3199-3204
31
君島健次郎ほか : 米子医誌. 1969; 20: 317-325
32
石飛達男ほか : 福岡医誌. 1969; 60: 806-809
33
周藤勝一ほか : 応用薬理. 1970; 4: 937-949
34
Patry G, et al. : Can J Physiol Pharmacol. 1971; 49: 568-572
35
Simler S, et al. : Biochem Pharmacol. 1973; 22: 1701-1708
36
Anlezark G, et al. : Biochem Pharmacol. 1976; 25: 413-417
37
Leviel V, et al. : Epilepsia. 1977; 18: 229-234
38
Cao BJ, et al. : Eur J Pharmacol. 1993; 237: 177-181