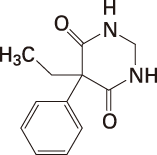
1
Sato J., et al.:J. Pharmacobio-Dyn. 1992;15(9):467-472
2
Carl G. F., et al.:Res. Commun. Chem. Pathol. Pharmacol. 1988;61(3):365-376
3
Martinez G., et al.:Neurology. 1973;23(4):381-383
4
細川清 他:医学のあゆみ. 1978;105:941-943
5
鈴木喜八郎 他:周産期医学. 1979;9:1259-1264
6
木戸日出喜 他:精神神経学雑誌. 1982;84:661-679
7
Houghton G. W., et al.:Eur. J. Clin. Pharmacol. 1975;9(1):73-78
8
Baumel I. P., et al.:Arch. Neurol. 1972;27(1):34-41
9
Frey H. H. & Hahn I.:Arch. Int. Pharmacodyn. 1960;128:281-290
10
Fujimoto J. M., et al.:J. Pharmacol. Exp. Ther. 1968;159(2):379-388
11
Lee C. S., et al.:J. Pharmacol. 1982;22(7):301-308
12
清野昌一:臨床精神医学. 1978;7:269-281
13
Buchthal F., et al.:Arch. Neurol. 1968;19(6):567-572
14
Goodman L. S., et al.:J. Pharmacol. Exp. Ther. 1953;108(4):428-436
15
Bogue J. Y., et al.:Br. J. Pharmacol. 1953;8(2):230-236







 525
525 525
525