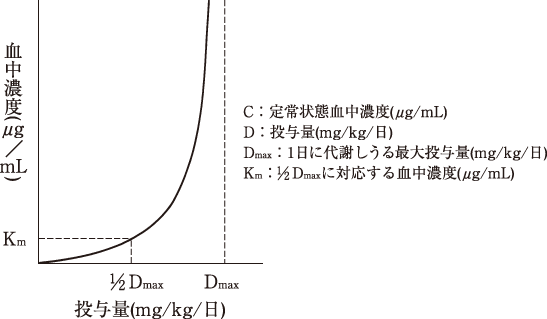
1
鈴木喜八郎ほか: 周産期医学. 1979; 9: 1259-1264
2
社内資料: アレビアチン経口剤の薬物速度論的パラメータ
3
Hooper W. D., et al.: Clin. Pharmacol. Ther. 1974; 15: 276-282
4
Butler T. C.: J. Pharmacol. Exp. Ther. 1957; 119: 1-11
5
Maynert E. W.: J. Pharmacol. Exp. Ther. 1960; 130: 275-284
6
Bajpai M., et al.: Drug Metab. Dispos. 1996; 24: 1401-1403
7
Kohda Y., et al.: J. Pharm. Dyn. 1983; 6: 46-55
8
Faucette S. R., et al.: Drug Metab. Dispos. 2004; 32: 348-358
9
Kutt H., et al.: JAMA. 1968; 203: 969-972
10
清野昌一: 臨床精神医学. 1978; 7: 269-281
11
西原カズヨほか: 医学のあゆみ. 1977; 103: 810-812
12
西原カズヨほか: 医学のあゆみ. 1978; 107: 512-514
13
Swinyard E. A.: J. Am. Pharm. Assoc. 1949; 38: 201-204
14
Swinyard E. A., et al.: J. Pharmacol. Exp. Ther. 1952; 106: 319-330
15
Goodman L. S., et al.: J. Pharmacol. Exp. Ther. 1953; 108: 168-176
16
Rall T. W. & Schleifer L. S.: GOODMAN and GILMAN's The Pharmacological Basis of Therapeutics 8th ed. Pergamon Press. 1990; 436-444
17
Korey S. R.: Proc. Soc. Exp. Biol. Med. 1951; 76: 297-299
18
Esplin D. W.: J. Pharmacol. Exp. Ther. 1957; 120: 301-323
19
Toman J. E. P.: Neurology. 1951; 1: 444-460