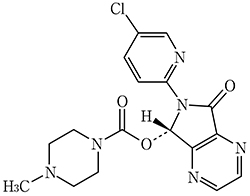
1
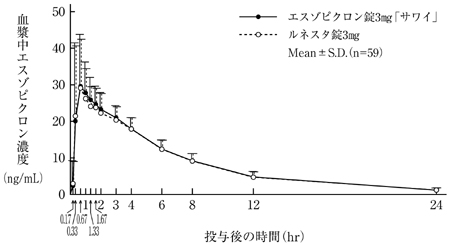
日本人及び白人の健康成人を対象とした臨床第Ⅰ相反復投与試験(外国試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.2)
2
松木俊二他:医学と薬学, 2021;78(5):597-606
3
日本人健康成人を対象とした含量の異なる製剤間の生物学的同等性試験及び食事の影響検討試験(国内試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.5)
4
代謝(ルネスタ錠:2012年1月18日承認、申請資料概要2.6.2.2, 2.6.4.5)
5
外国人健康成人を対象としたマスバランス試験(外国試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.23)
6
腎機能障害患者を対象とした薬物動態試験(外国試験)①(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.11)
7
腎機能障害患者を対象とした薬物動態試験(外国試験)②(ルネスタ錠:2012年1月18日承認、審査報告書)
8
肝機能障害患者を対象とした薬物動態試験(外国試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.10)
9
日本人健康高齢者を対象とした臨床第Ⅰ相反復投与試験(国内試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.4)
10
ケトコナゾールとの薬物間相互作用試験(外国試験)(ルネスタ錠:2012年1月18日承認、申請資料概要 2.7.6.19)
11
アルコールとの薬物相互作用試験(外国試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.12)
12
オランザピンとの薬物間相互作用試験(外国試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.14)
13
ロラゼパムとの薬物間相互作用試験(外国試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.15)
14
パロキセチンとの薬物間相互作用試験(外国試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.16)
15
ジゴキシンとの薬物間相互作用試験(外国試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.18)
16
ワルファリンとの薬物間相互作用試験(外国試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.17)
17
社内資料:生物学的同等性試験(錠1mg)
18
社内資料:生物学的同等性試験(錠2mg)
19
原発性不眠症患者を対象とした臨床第Ⅱ/Ⅲ相試験(国内試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.24)
20
不眠症患者を対象とした臨床第Ⅲ相試験(国内試験)①(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.25)
21
不眠症患者を対象とした臨床第Ⅲ相試験(国内試験)②(ルネスタ錠:2012年1月18日承認、審査報告書)
22
原発性不眠症患者を対象とした用量反応試験(外国試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.26)
23
Zammit, G. K. et al.:Curr. Med. Res. Opin., 2004;20(12):1979-1991
24
McCall, W. V. et al.:Curr. Med. Res. Opin., 2006;22(9):1633-1642
25
Scharf, M. et al.:Sleep, 2005;28(6):720-727
26
原発性不眠症患者を対象とした長期投与試験(外国試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.28)
27
Walsh, J. K. et al.:Sleep, 2007;30(8):959-968
28
原発性不眠症患者を対象とした臨床第Ⅲ相試験(外国試験)①(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.27)
29
原発性不眠症患者を対象とした臨床第Ⅲ相試験(外国試験)②(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.29)
30
高齢者原発性不眠症患者を対象とした臨床第Ⅲ相試験(外国試験)①(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.30)
31
高齢者原発性不眠症患者を対象とした臨床第Ⅲ相試験(外国試験)②(ルネスタ錠:2012年1月18日承認、申請資料概要2.7.6.31)
32
Hanson, S. M. et al.:J. Med. Chem., 2008;51(22):7243-7252
33
GABAA受容体サブタイプ発現細胞におけるGABA誘発電流増強作用(ルネスタ錠:2012年1月18日承認、申請資料概要2.6.1, 2.6.2.2.1, 2.6.2.2.2)
34
マウスの脳波に対する作用(ルネスタ錠:2012年1月18日承認、申請資料概要2.6.2.2.4.1)
35
ラットの脳波に対する作用(ルネスタ錠:2012年1月18日承認、申請資料概要2.6.2.2.4.2)
36
Xi, M. et al.:Sleep, 2008;31(7):1043-1051
37
マウスにおける鎮静作用(ルネスタ錠:2012年1月18日承認、申請資料概要2.6.2.3.4)
38
マウスにおける抗不安作用(明暗箱試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.6.2.3.3.1)
39
Carlson, J. N. et al.:Eur. J. Pharmacol., 2001;415(2-3):181-189
40
サルにおける抗不安作用(コンフリクト試験)(ルネスタ錠:2012年1月18日承認、申請資料概要2.6.2.3.3.3)
41
サルにおける鎮静作用(ルネスタ錠:2012年1月18日承認、申請資料概要2.6.2.3.4.3)