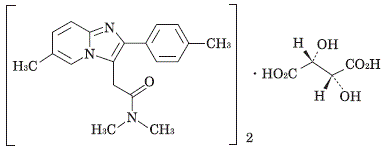
1
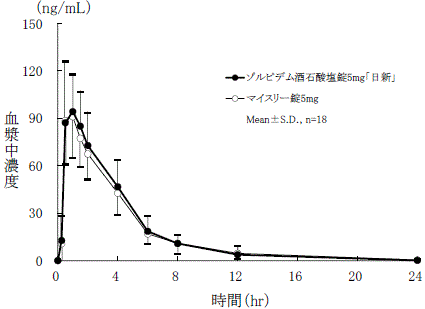
社内資料:生物学的同等性試験(錠5mg)
2
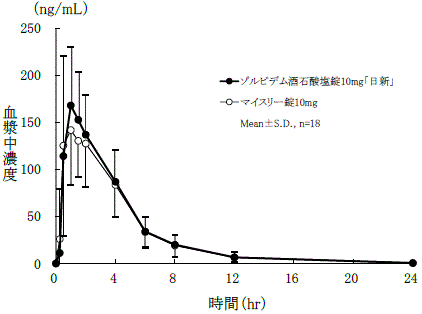
社内資料:生物学的同等性試験(錠10mg)
3
Pons,G.et al.:Eur.J.Clin.Pharmacol.1989;37(3):245-248
4
海外健康成人・薬物動態(マイスリー錠:2002年9月22日承認、申請資料概要ヘ.2.3)(1)、(2))
5
ラット及びマウスでの代謝物及び類縁物質の薬理作用(マイスリー錠:2002年9月22日承認、申請資料概要ホ.1.5))
6
Pichard,L.et al.:Drug Metab.Dispos.1995;23(11):1253-1262
7
Moltke,L.L.et al.:Br.J.Clin.Pharmacol.1999;48(1):89-97
8
海外慢性腎障害患者・薬物動態(マイスリー錠:2002年9月22日承認、申請資料概要ヘ.3.2)(3))
9
海外肝硬変患者・薬物動態(マイスリー錠:2002年9月22日承認、申請資料概要ヘ.3.2)(2))
10
高齢不眠症患者・薬物動態(マイスリー錠:2002年9月22日承認、申請資料概要ヘ.3.2)(1))
11
Villikka,K.et al.:Clin.Pharmacol.Ther.1997;62(6):629-634
12
第十八改正日本薬局方解説書.東京:廣川書店;2021.C3033-3038