1
工藤義雄 他:臨床医薬 1990;6(4):651-675[MYS-00097]
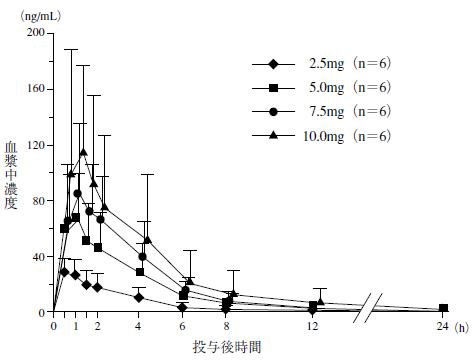
2
社内資料:海外健康成人・バイオアベイラビリティ試験(2002年9月22日承認 申請資料概要へ.3.3)(2))(DIR000028)
3
Pons, G. et al.:Eur. J. Clin. Pharmacol. 1989;37(3):245-248[MYS-00032]
4
石橋光治 他:薬物動態 1993;8(4):445-455[MYS-00120]
5
社内資料:海外健康成人・薬物動態(2002年9月22日承認 申請資料概要へ.2.3)(1)、(2))(DIR000014)
6
Pichard, L. et al.:Drug Metab. Dispos. 1995;23(11):1253-1262[MYS-00199]
7
Moltke, L. L. et al.:Br. J. Clin. Pharmacol. 1999;48(1):89-97[MYS-00346]
8
社内資料:海外慢性腎障害患者・薬物動態(2002年9月22日承認 申請資料概要ヘ.3.2)(3))(DIR000016)
9
社内資料:海外慢性腎障害患者・薬物動態(2002年9月22日承認 申請資料概要ヘ.3.2)(3))(DIR000018)
10
社内資料:海外肝硬変患者・薬物動態(2002年9月22日承認 申請資料概要ヘ.3.2)(2))(DIR000015)
11
社内資料:高齢不眠症患者・薬物動態(2002年9月22日承認 申請資料概要ヘ.3.2)(1))(DIR000024)
12
Villikka, K. et al.:Clin. Pharmacol. Ther. 1997;62(6):629-634[MYS-00249]
13
工藤義雄 他:臨床医薬 1993;9(Suppl.2):57-79[MYS-00106]
14
工藤義雄 他:臨床医薬 1993;9(1):79-105[MYS-00099]
15
筒井末春 他:臨床医薬 1993;9(2):387-413[MYS-00102]
16
筒井末春 他:臨床医薬 2000;16(5):649-669[MYS-00466]
17
社内資料:ラット大脳皮質・薬理作用(2002年9月22日承認 申請資料概要ホ.1.3)(1)、(2))(DIR000009)
18
社内資料:ラット小脳他・薬理作用(2002年9月22日承認 申請資料概要ホ.1.3)(1))(DIR000019)
19
延原健二 他:神経精神薬理 1992;14(2):137-144[MYS-00098]
20
菅野 道 他:神経精神薬理 1993;15(9):589-602[MYS-00123]
21
中込和幸 他:神経精神薬理 1993;15(9):603-615[MYS-00116]
22
Nakajima, T. et al.:Psychiatry Clin. Neurosci. 2000;54(1):37-40[MYS-00457]
23
Nakajima, T. et al.:Life Sci. 2000;67(1):81-90[MYS-00491]
24
鈴木牧彦 他:神経精神薬理 1993;15(6):375-389[MYS-00136]
25
内海光朝 他:神経精神薬理 1994;16(1):45-56[MYS-00154]
26
Isawa, S. et al.:日本神経精神薬理学雑誌 2000;20(2):61-69[MYS-00492]
27
Uchiumi, M. et al.:日本神経精神薬理学雑誌 2000;20(3):123-130[MYS-00518]
28
佐藤 壽 他:ブレインサイエンス 1994;5(3):309-320[MYS-00444]
29
社内資料:ネコ・薬理作用(2002年9月22日承認 申請資料概要ホ.1.1)(1)ii)(DIR000001)
30
社内資料:ラット・薬理作用(2002年9月22日承認 申請資料概要ホ.1.1)(1)iii)(DIR000002)
31
社内資料:ネコ・薬理作用(2002年9月22日承認 申請資料概要ホ.1.1)(2)i)(DIR000003)
32
社内資料:ラット・薬理作用(2002年9月22日承認 申請資料概要ホ.1.1)(2)ii)(DIR000004)
33
社内資料:マウス・薬理作用(2002年9月22日承認 申請資料概要ホ.1.2)(1))(DIR000020)
34
社内資料:ラット・薬理作用(2002年9月22日承認 申請資料概要ホ.1.2)(2))(DIR000007)
35
社内資料:マウス・薬理作用(2002年9月22日承認 申請資料概要ホ.1.2)(5))(DIR000008)





 601
601