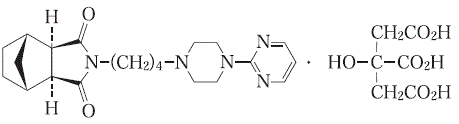
1
河南 昇ほか: 基礎と臨床. 1992; 26: 1803-1823
2
水野佳子ほか: 基礎と臨床. 1992; 26: 1903-1945
3
中島光好ほか: 基礎と臨床. 1992; 26: 4143-4165
4
筒井末春ほか: 基礎と臨床. 1992; 26: 4252-4263
5
筒井末春ほか: 基礎と臨床. 1992; 26: 4265-4288
6
村崎光邦ほか: 臨床評価. 1992; 20: 259-293
7
筒井末春ほか: 基礎と臨床. 1992; 26: 4289-4309
8
長田洋文ほか: 基礎と臨床. 1992; 26: 4311-4350
9
木村政資ほか: 臨床評価. 1992; 20: 225-257
10
村崎光邦ほか: 臨床評価. 1992; 20: 295-329
11
菊池長徳ほか: 基礎と臨床. 1992; 26: 4351-4367
12
筒井末春ほか: 基礎と臨床. 1992; 26: 4217-4225
13
工藤義雄ほか: 基礎と臨床. 1992; 26: 4191-4201
14
村崎光邦ほか: 基礎と臨床. 1992; 26: 4203-4216
15
木村政資ほか: 基礎と臨床. 1992; 26: 4239-4251
16
兼本成斌ほか: 基礎と臨床. 1992; 26: 4227-4238
17
筒井末春ほか: 基礎と臨床. 1992; 26: 5475-5492
18
清水宏志ほか: Jap. J. Pharmacol. 1988; 46: 311-314
19
清水宏志ほか: 基礎と臨床. 1992; 26: 1681-1695
20
清水宏志ほか: Jap. J. Pharmacol. 1992; 58: 283-289
21
龍野 徹ほか: Pharmacol. Biochem. Behav. 1989; 32: 1049-1055
22
S. Wieland., et al.: Psychopharmacol. 1990; 101: 497-504
23
辻 良三ほか: Arch. int. Pharmacodyn. 1991; 311: 131-143
24
原 千高ほか: 薬物・精神・行動. 1989; 9: 110-110
25
清水宏志ほか: Jap. J. Pharmacol. 1987; 45: 493-500




 034
034
 044
044