1
第十八改正日本薬局方解説書.2021;C-3022-3028
2
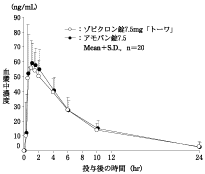
社内資料:生物学的同等性試験(錠7.5mg)
3
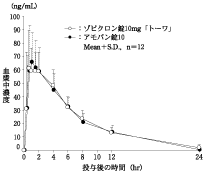
社内資料:生物学的同等性試験(錠10mg)
4
L.Becquemont,et al.:Drug Metab.Dispos.1999;27(9):1068-1073
5
小林亮三 他:臨床評価.1986;14(1):77-108
6
大友英一:老年医学.1985;23(6):971-992
7
百瀬隆 他:診療と新薬.1983;20(10):2347-2357
8
J.C.Blanchard,et al.:Int.Pharmacopsychiatry.1982;17(S-2):59-69/Pharmacology.1983;27(S-2):59-69
9
菅野道 他:帝京医学雑誌.1983;6(3):311-320
10
田中正敏 他:Eur.J.Clin.Pharmacol.1983;24:469-474
11
植木昭和 他:福岡医学雑誌.1983;74(8):550-567
12
安東潔 他:実中研・前臨床研究報.1985;11(1):1-20
13
田辺恭子 他:米子医学雑誌.1983;34(3):285-295








 0120-108-932 FAX 06-7177-7379
0120-108-932 FAX 06-7177-7379

