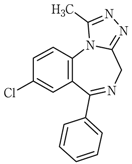
1
Uguz F.:Am J Ther. 2021;28:e118-e126
2
Oo C.Y. et al.:Br J Clin Pharmacol. 1995;40:231-236
3
Furugen A. et al.:J Pharm Biomed Anal. 2019;168:83-93
4
Nishimura A. et al.:Breastfeed Med. 2021;16:424-431
5
Saito J. et al.:J Pharm Health Care Sci. 2022;8(10):1-5
6
Guven H. et al.:Clin.Pharmacol.Ther. 1993;54:42-44
7
黒沢光樹 他:臨牀と研究. 1981;58:2301-2312
8
三好秋馬 他:薬理と治療. 1981;9:1165-1173
9
八代信義 他:臨牀と研究. 1981;58:1963-1970
10
植木昭和 他:日薬理誌. 1981;77:483-509






 147
147


 148
148