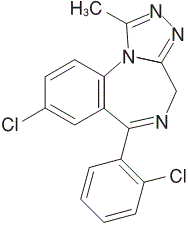
1
第十八改正日本薬局方解説書 廣川書店 2021;C3618-C3624
2
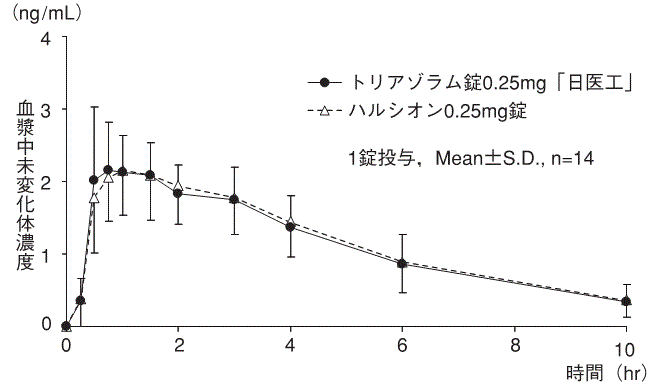
社内資料:生物学的同等性試験(錠0.25mg)
3
Eberts F. S. Jr., et al.:Clin. Pharmacol. Ther. 1981;29(1):81-93
4
Kitagawa H., et al.:Xenobiotica. 1979;9(7):415-428
5
Kitagawa H., et al.:Xenobiotica. 1979;9(7):429-439
6
社内資料:生物学的同等性試験(錠0.125mg)
7
酒井瑛 他:臨床と研究. 1979;56(11):3826-3832
8
工藤義雄 他:医学のあゆみ. 1980;113(2):120-140
9
栗原雅直 他:臨床評価. 1980;8(1):79-110
10
橘直矢 他:臨牀と研究. 1979;56(11):3776-3790
11
君島健次郎 他:米子医学雑誌. 1976;27(4):314-323
12
古川達雄 他:医学研究. 1975;45(5):285-302
13
植木昭和 他:日本薬理学雑誌. 1978;74(5):597-614
14
五味田裕 他:日本薬理学雑誌. 1978;74(5):615-628
15
中澤和嘉 他:臨床精神医学. 1977;6(10):1415-1425








 710
710 710
710